Insbesondere universitäre Einrichtungen veröffentlichen regelmäßig medizinische Software als Open Source. Dies lässt Zweifel aufkommen, ob es sich bei dieser Open-Source-Software um ein Medizinprodukt handelt und welche regulatorischen Risiken und (Produkt-)Haftungsrisiken damit verbunden sind.
Dieser Artikel bietet einen schnellen Überblick.
- Sterben rechtliche und finanzielle Risiken hängen davon ab, ob die Open-Source-Software als Medizinprodukt gilt und ob sie in Verkehr gebracht wurde.
- Die regulatorischen Anforderungen hängen nicht davon ab, ob eine Software Open Source ist in Umlauf gebracht wird.
- Entwickler von Open-Source-Software sollten und können unbeabsichtigtes Inverkehrbringen eines Medizinprodukts und die damit verbundenen Haftungsrisiken.
- Auch bei „Open-Source-Medizinprodukten“ gilt nicht nur das Produkt, sondern auch das Hersteller/Händler haben zahlreiche rechtliche Verpflichtungen erfüllen.
1. Rolle von Open-Source-Software in medizinischen Geräten
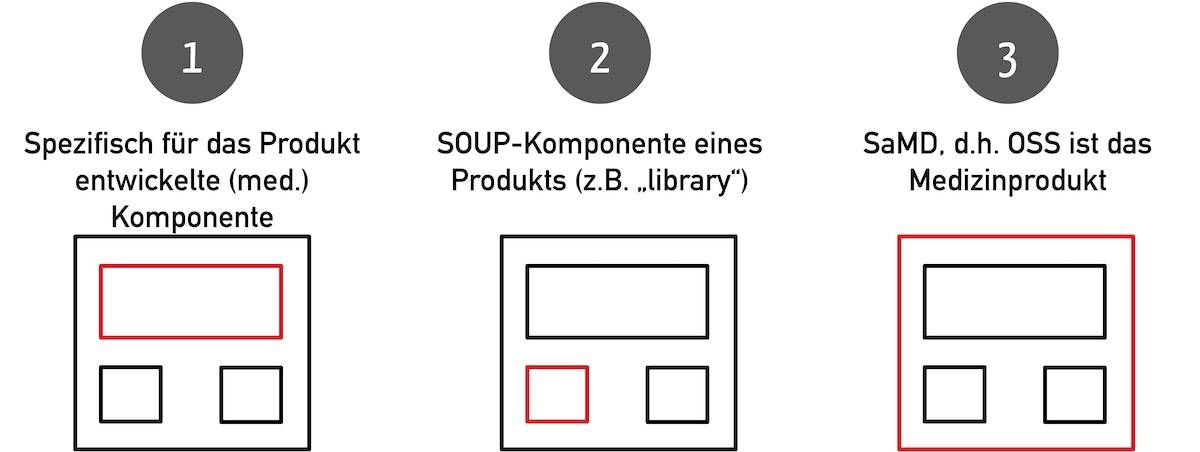
Open-Source-Software kann sowohl das medizinische Gerät als auch ein Teil davon sein. Folgende Konstellationen sind möglich: Die Open-Source-Software ist
- eine speziell für das Medizingerät entwickelte Komponente (z. B. ein KI-Modell mit zugehöriger API) oder
- eine handelsübliche Komponente, die im medizinischen Gerät verwendet wird, z. B. eine Bibliothek oder
- das Medizinprodukt selbst
2. Rechtliche Einordnung
Eine Haftung entsteht insbesondere dann, wenn ein Medizinprodukt in Verkehr gebracht wird. Daher müssen zwei Fragen geklärt werden:
- Wann gilt ein Produkt als Medizinprodukt?
- Wann erfolgt ein Inverkehrbringen?
A. Wenn ein Produkt als Medizinprodukt gilt
Nicht die Funktionalität eines Produktes entscheidet über dessen Eignung (Entscheidung, ob es sich um ein Medizinprodukt handelt oder nicht), sondern sein Verwendungszweck.
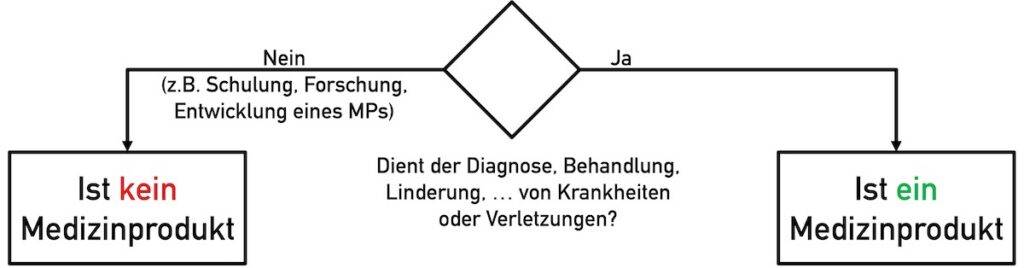
Dadurch vermeiden Entwickler von Open-Source-Software, dass ihre Arbeitsergebnisse beispielsweise für folgende Zwecke als Medizinprodukt gelten:
- Das Produkt dient der Forschung oder der Dokumentation von Forschungsergebnissen
- Zur Entwicklung medizinischer Produkte soll/darf Software eingesetzt werden
- Für die Schulung wird Open-Source-Software verwendet
Besonders hilfreich ist auch der Hinweis, dass es sich bei der Software nicht um ein Medizinprodukt handelt und nicht dazu bestimmt ist, Krankheiten und Verletzungen zu diagnostizieren, zu lindern, zu behandeln oder vorherzusagen.
Eine (bedauerliche) Ausnahme von der Regel, dass der Zweck und nicht die Funktionalität die Qualifikation bestimmt, findet sich in der MDCG-Richtlinie 2019-11. Demnach gilt Software, die lediglich der Weiterleitung, Speicherung und Anzeige von Daten (unverändert) dient, nicht als Medizinprodukt.
Die Definition, was ein Medizinprodukt ist, variiert in verschiedenen Rechtsbereichen. Nach Angaben des US-amerikanischen FD&C unterliegen beispielsweise viele Softwareprogramme nicht der Durchsetzung durch die FDA.
B. Wenn es zu einer Inverkehrbringung kommt
Die MDR definiert in Artikel 2 (§§ 27 und 28), was ein Inverkehrbringen ist:
Jede Erstlieferung eines Produkts, sei es gegen Bezahlung oder unentgeltlich […] zum Vertrieb, Verbrauch oder zur Nutzung auf dem Unionsmarkt im Rahmen einer kommerziellen Tätigkeit;
§§ 27 und 28, Artikel 2 MDR
Der Konsum oder die Verwendung eines Medizinprodukts in einer Arztpraxis oder einem Krankenhaus gilt als gewerbliche Tätigkeit, auch wenn diese Tätigkeit nicht auf Erwerbszweck ausgerichtet ist.
Dabei spielt es laut Definition keine Rolle, ob der Beitrag bezahlt oder – wie es bei Open-Source-Software häufig der Fall ist – kostenlos ist.
Ist die Open-Source-Software nur für den Einsatz innerhalb der Gesundheitseinrichtung vorgesehen, in der sie entwickelt wurde, kommt eine Eigenproduktion gemäß MDR/IVDR Artikel 5, Abschnitt 5 in Betracht.
3. Gesetzliche Verpflichtungen
A. Medizinprodukterecht
Gilt die Open-Source-Software als Medizinprodukt, das in Verkehr gebracht wird oder werden soll, müssen deren Hersteller alle regulatorischen Anforderungen an Medizinprodukte erfüllen.
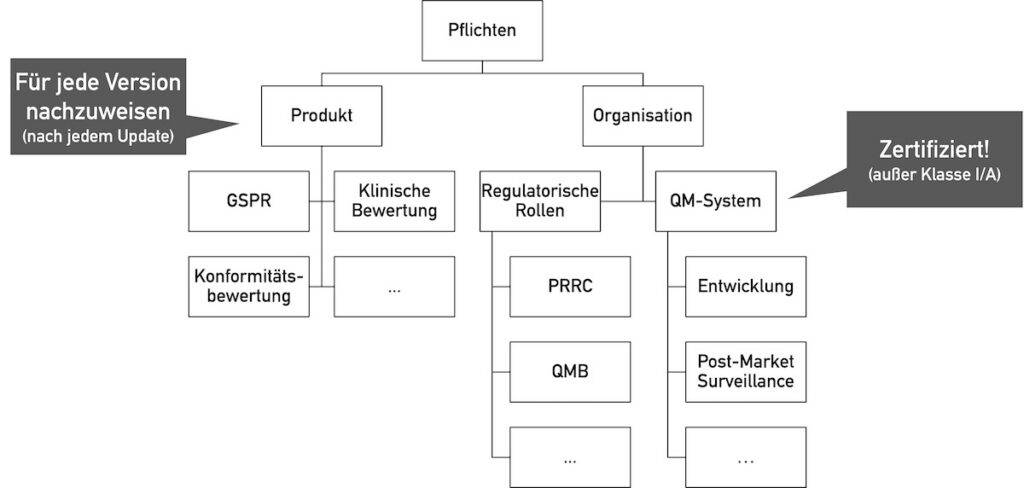
Diese Anforderungen betreffen sowohl das Medizinprodukt als auch die Organisation, die das Medizinprodukt auf den Markt bringt.
Die wichtigsten grundlegenden Sicherheits- und Leistungsanforderungen (GSPR) für Software betreffen:
Darüber hinaus ist ein Qualitätsmanagementsystem gemäß ISO 13485 bzw. Anhang IX der MDR/IVDR erforderlich. Dazu gehört auch ein Post-Market-Überwachungssystem.
Leider bestehen viele deutsche Behörden auf einer Einstufung in die Klasse IIa oder höher, unabhängig von den gesetzlichen Vorgaben im Anhang VIII der MDR (insbesondere Regel 11).
Allerdings sind die meisten gesetzlichen Verpflichtungen wie die GSPR weitgehend unabhängig von der Softwareklasse.
B. Weitere gesetzliche Anforderungen
Zusätzlich und unabhängig vom Medizinprodukterecht müssen Hersteller möglicherweise andere „horizontale“ Vorschriften einhalten, wie zum Beispiel:
Die Anwendbarkeit und relevanten Anforderungen dieser Vorschriften hängen von der Rolle der Open-Source-Entwickler ab.
Das KI-Gesetz stellt keine Anforderungen an Open-Source-KI-Systeme.
4. Auswertungs- und Anwendungsbeispiele
A. Vorteile von Open-Source-Medizinsoftware
Die Entwickler von Open-Source-Medizinprodukten argumentieren mit folgenden Vorteilen:
- Open Source fördert Innovationen und bringt Innovationen schnell ans Krankenbett.
- Die Entwicklungsergebnisse stehen jedem zur Verfügung, unabhängig von seinen finanziellen Möglichkeiten.
- Der Transparenz- und Community-Ansatz hilft, Fehler schnell zu finden und zu beheben, was die Patientensicherheit fördert.
- Es besteht beispielsweise kein Interessenkonflikt wie bei herstellerfinanzierten klinischen Studien.
B. Herausforderungen bei Open-Source-Medizingeräten
Die Entwicklung von Open-Source-Medizinprodukten muss spezifische Herausforderungen bewältigen:
- Erforderlich ist eine Organisation mit einem (zertifizierten) Qualitätsmanagementsystem und allen regulatorischen Rollen wie dem QMB und dem PRRC.
- Die Fähigkeiten müssen auch regulatorische Anforderungen außerhalb der Entwicklung erfüllen, beispielsweise im Qualitäts- und Risikomanagement, im Usability Engineering und in Regulatory Affairs.
- Die hohen Post-Market-Kosten müssen über Jahre anfallen und finanziert werden, zumindest solange ein Produkt noch auf dem Markt ist.
- Da keine Verkäufer-Käufer-Beziehung besteht, ist die Kommunikation mit Kunden/Nutzern schwieriger, was unter anderem das Risikomanagement und die Überwachung nach dem Inverkehrbringen anspruchsvoller macht.
- Personalfluktuation, beispielsweise bei Doktoranden, macht es noch schwieriger, Kompetenzen langfristig zu sichern.
- Die Kontrolle (Erstellung, Überprüfung, Freigabe) von Artefakten wie Dokumenten und Quellcode erfordert besondere Aufmerksamkeit in einer Community, die keiner Organisation entspricht.
Das Diabetes-Dosiersystem von Tidepool basiert auf Open-Source-Software. Das Unternehmen hat hier seinen regulatorischen Weg beschrieben.
5. FAQ
A. Wie vermeide ich als Open-Source-Entwickler eine Klage?
Das Risiko, verklagt zu werden, lässt sich nicht ausschließen, die Wahrscheinlichkeit aber schon. Das Risiko ist umso größer
- ein möglicher Rechtsverstoß offensichtlicher ist,
- höher die wirtschaftliche Relevanz des Produkts (z. B. für Wettbewerber) und
- der Beklagte ist finanziell leistungsfähiger.
Andererseits ist es hilfreich, den Zweck und die Ansprüche sehr konsistent und transparent zu formulieren und die Anwendbarkeit regulatorischer Anforderungen zu recherchieren und einzuhalten.
Darüber hinaus unterstützt das Johner Institut Entwickler von Open-Source-Produkten bei ihrer Regulierungsstrategie. Einerseits mit dem Ziel, die Qualifizierung als Medizinprodukt zu vermeiden bzw. zu erreichen, andererseits mit dem Ziel, regulatorische Sicherheit und Konformität zu erreichen.
Bei Interesse kontaktieren Sie uns einfach über das Kontaktformular.
B. Muss ich ein CE-Zeichen anbringen? Wenn ja, wo?
Mit der CE-Kennzeichnung erklärt der Inverkehrbringer des Produkts die Konformität mit den geltenden EU-Richtlinien oder -Verordnungen. Diese Kennzeichnung ist nur zulässig und zugleich erforderlich, wenn das Produkt in den Geltungsbereich einer dieser Richtlinien oder Verordnungen fällt und dort die CE-Kennzeichnung erforderlich ist.
C. Was muss ich bei der Nutzung von Github beachten?
IT-Systeme zur Versions- und Konfigurationsverwaltung sowie zum Betrieb von CI/CD-Pipelines gelten als computergestützte Systeme im Rahmen des QM-Systems und müssen daher einer computergestützten Systemvalidierung unterzogen werden.
Diese Systeme müssen die gesetzlich und normativ geforderte Dokumentenkontrolle gewährleisten, allerdings ist dies eher eine Frage der korrekten Konfiguration und weniger der Leistungsmerkmale dieser Systeme.
D. So dokumentieren Sie ein Open-Source-SaMD für die FDA-Zulassung
Für Open-Source-SaMD gelten die gleichen regulatorischen Anforderungen wie für alle anderen SaMD. Dazu gehören:
- Technische Dokumentation vergleichbar mit MDR
- Als Teil davon eine Cybersicherheitsdatei
- Qualitätsmanagement nach 21 CFR Teil 820
- Eine Freigabe der FDA, zum Beispiel im Rahmen einer 510(k)- oder De-novo-Zulassung.
e. Wer kann mir helfen?
Die (Software-)Experten des Johner Instituts helfen bei allen Fragen rund um die Dokumentation, Genehmigung und Einrichtung eines Managementsystems. Gleiches gilt für die vorgeschriebenen Tests wie Usability-Tests, Pen-Tests und klinische Tests.
6. Fazit und Zusammenfassung
Viele universitäre Einrichtungen unterschätzen den Aufwand, Medizinprodukte gesetzeskonform zu entwickeln, in Verkehr zu bringen und zu überwachen. Professionelles Software-Engineering ist eine notwendige, aber bei weitem nicht ausreichende Voraussetzung.
Es kann hilfreich sein, Forschung und Entwicklung zu trennen und sich der Kommerzialisierung nicht grundsätzlich zu verschließen, zumal sich dies nicht mit dem Open-Source-Gedanken ausschließt. Denn Gutes für Patienten zu tun kostet nicht nur Zeit, sondern leider auch Geld.
Ähnliche Beiträge
Automotive
Agen Togel Terpercaya
Bandar Togel
Sabung Ayam Online
Berita Terkini
Artikel Terbaru
Berita Terbaru
Penerbangan
Berita Politik
Berita Politik
Software
Software Download
Download Aplikasi
Berita Terkini
News
Jasa PBN
Jasa Artikel